Beim WCLC 2024 wurden Daten zu Tarlatamab als Monotherapie (
DeLLphi-301, 3L+) und als Bestandteil der Erhaltung nach Erstlinientherapie (DeLLphi-303) bei Patient:innen mit ES-SCLC präsentiert.
Tarlatamab beim ES-SCLC
Tarlatamab Sustained Clinical Benefit and Safety in Previously Treated SCLC: DeLLphi-301 Extended Follow-Up – Sands et al. #OA10.03
Nach der
Primäranalyse vom ESMO 2023, mit einem medianen Follow-Up von ca. 10 Monaten, wurden nun Daten nach einer längeren Nachbeobachtungszeit von 16,6 Monaten bzw. 20,7 Monaten für das OS berichtet.
Ergebnisse
Wirksamkeit
IBei vorbehandelten ES-SCLC Patient:innen, die mit 10 mg Tarlatamab Q2W behandelt wurden, lag das mOS bei 15,2 Monaten. Das mOS war dabei unabhängig davon, ob das progressionsfreie Intervall nach der Erstlinien-CTx kleiner oder größer als 90 Tage war (s. Abbildung 1).
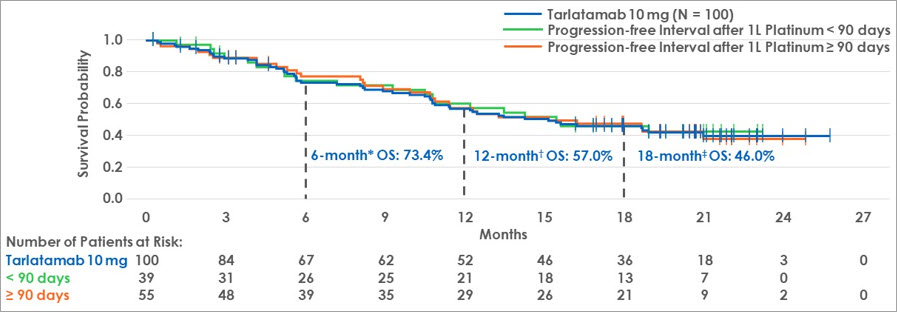
Abbildung 1 Länge des mOS in Abhängigkeit des PFS nach 1L Platinumtherapie (<90 Tage vs. ≥90 Tage)
Bei einer Ansprechrate von 40% lag die mediane Dauer des Ansprechens bei 9,7 Monaten und 26 % der Patient:innen zeigten eine anhaltende Krankheitskontrolle von mind. 52 Wochen. Zum Zeitpunkt des Data-Cut-off zeigten noch 17/40 Responder ein anhaltendes Ansprechen.
Verträglichkeit
Die häufigsten TRAEs waren CRS, Fieber, verringerter Appetit, Geschmacksstörungen und Fatigue, wobei die Inzidenz von allen TRAEs in den ersten 3 Monaten der Behandlung am höchsten war. Lediglich ein verringerter Appetit trat auch noch nach 12 Monaten bei mehr als 5% (8%) auf. Ein CRS trat primär nach den ersten beiden Dosen in Zyklus 1 auf und war, mit einer Ausnahme, von Grad 1 oder 2. Lediglich 3% der Patient:innen entwickelten auch in Zyklus 2 oder später noch ein CRS.
ICANS traten bei 15% der Patient:innen (alle Grad 1 o. 2) und immer innerhalb der ersten 12 Monate auf.
Fazit
Die Autoren schlussfolgern, dass Tarlatamab 10 mg Q2W bei vorbehandelten Patient:innen mit ES-SCLC ein anhaltendes Ansprechen (9,7 Mo.) und ein beeindruckendes mOS (15,2 Mo.), bei einem bekannten Verträglichkeitsprofil, zeigt.
Sie können die Präsentation
hier herunterladen.
Tarlatamab with a PD-L1 Inhibitor as First-Line Maintenance After Chemo-Immunotherapy for ES-SCLC – Lau et al. #OA10.04
Die Phase 1b-DeLLphi-303-Studie untersucht die Kombination von Tarlatamab 10 mg Q2W zusammen mit einem PD-L1-Inhibitor (Durvalumab o. Atezolizumab) als Erstlinienerhaltungstherapie für Patient:innen, die nach 4-6 Zyklen Induktion mit einem Platinderivat + Etoposid + PD-L1-Inhibitor progressionsfrei sind.
Ergebnisse
Wirksamkeit
Nach einem medianen Follow-Up von 10 Monaten betrug die DCR sowohl im Tarlatamab + Atezolizumab-Arm (30/48) als auch im Tarlatamab + Durvalumab-Arm (25/40) 62,5%. Das mediane PFS nach Beginn der Erhaltungsphase lag bei 5,6 Monaten für Tarlatamab + Atezolizumab und 5,3 Monaten für Tarlatamab + Durvalumab (s. Abbildung 2). Nach neun Monaten Erhaltungstherapie waren noch 88,9% der Patient:innen am Leben und 39,3% progressionsfrei.
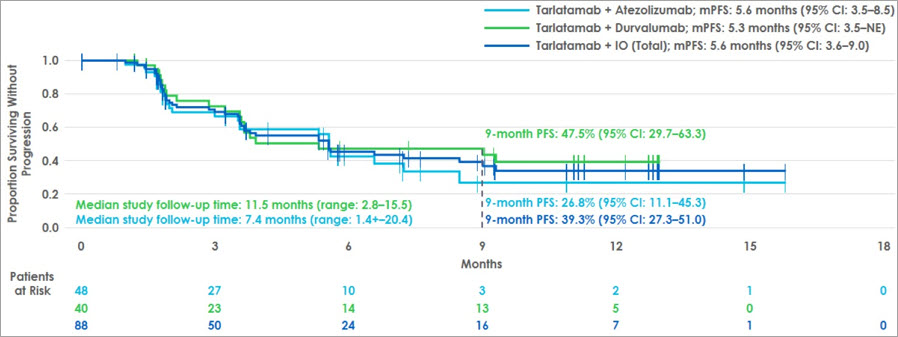
Abbildung 2 Medianes PFS nach Start der Erhaltungstherapie mit Tarlatamab + IO
Verträglichkeit
Die Kombinationstherapie zeigte ein gutes Verträglichkeitsprofil mit einer geringen Abbruchrate von Tarlatamab (6%). Die Rate an CRS oder ICANS (hauptsächlich Grad 1/2) war ähnlich hoch wie bei der Tarlatamab-Monotherapie (
DeLLphi-301) und diese traten ebenfalls hauptsächlich im ersten Zyklus der Erhaltungstherapie auf. Es traten keine neuen und/oder unerwarteten Toxizitäten auf und die Rate an immunbedingten unerwünschten Ereignissen war gering (2,3%).
Fazit
Die Kombination aus Tarlatamab + PD-L1-Inhibitor zeigte ein kontrollierbares Verträglichkeitsprofil mit einer anhaltenden Krankheitskontrolle und vielversprechenden Überlebensdaten. Diese Daten legen die Grundlage für die 1L- Maintenance Studie DeLLphi-305, die auch in Österreich rekrutieren wird.
Sie können die Präsentation
hier herunterladen.



