AMG 193 ist ein first-in-class MTA-kooperativer PRMT5-Inhibitor, der gezielt die Funktion von PRMT5 blockiert und somit das Wachstum von Tumoren unterdrücken könnte. AMG 193 wird aktuell in einer Reihe von klinischen Studien für verschiedene Entitäten getestet.
AMG 193 – solide Tumore mit MTAP-Deletion
Phase 1 dose escalation and initial dose expansion results of AMG 193, an MTA-cooperative PRMT5 inhibitor, in patients (pts) with MTAP-deleted solid tumors – Sacher et al. #640
In dieser Phase-1-Studie wurden vortherapierte Patient:innen (median: 2 Linien, >80% in Stage IV) mit NSCLC, PDAC, BTC und weiteren soliden Tumoren, die eine MTAP- oder CDKN2A-Deletion aufweisen, mit AMG 193 behandelt. Primärer Endpunkt waren das Festlegen der RP2D/MTD sowie die Evaluierung der Verträglichkeit.
Wirksamkeit:
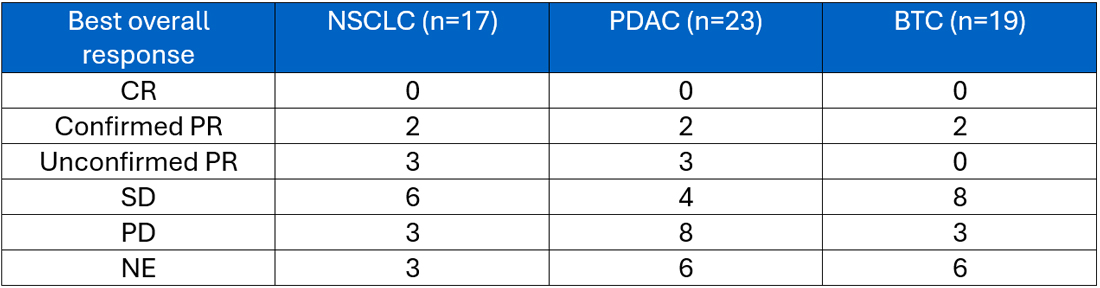
Bei den Dosis-Stufen 800 mg QD, 1200 mg QD, 600 mg BID zeigten 2/17 NSCLC-Patient:innen, 2/23 PDAC-Patient:innen und 2/19 BTC-Patient:innen ein bestätigtes Ansprechen. Je drei NSCLC- und PDAC-Patient:innen hatten ein noch nicht bestätigtes Ansprechen (siehe Tabelle 1).
Die mediane Dauer des Ansprechens lag bei 8,3 Monaten (95% KI: 2,7-NR), die mediane Dauer der Krankheitskontrolle 9,2 Monate (95% KI: 4,9-11,8).
Tabelle 1 Ansprechen für verschiedene Entitäten in den Dosisstufen 800 mg QD, 1200 mg QD, 600 mg BID
Verträglichkeit:
Übelkeit, Erbrechen und Fatigue waren die häufigsten unerwünschten Ereignisse in beiden Phasen (Exploration und Expansion). Bei der maximal tolerierten Dosis (1200 mg) traten in der Dose Expansion bei 83,9% der Patient:innen behandlungsbedingte unerwünschte Ereignisse (TRAEs) auf, davon 18,4% ≥Grad 3. Übelkeit (57,5%), Erbrechen (34,5%) und Fatigue (25,3%) waren auch in dieser Kohorte die häufigsten TRAEs.
In der Dose Exploration berichteten 2/18 Patient:innen in der 1200 mg QD Kohorte über dosislimitierende Toxizitäten (Grad 3 Erbrechen, Grad 3 Hypokaliämie). Es wurden keine dosislimitierenden Zytopenien berichtet.
Fazit:
AMG 193 zeigte ein akzeptables Verträglichkeitsprofil ohne Evidenz für eine klinisch signifikante Myelosuppression. Eine Dosis von 1200 mg QD konnte als MTD/RP2D festgelegt werden und wird in der laufenden Dose Expansion weiter untersucht.


