Beim ESMO 2023 wurden unter anderem die ersten Ergebnisse der CodeBreak 300 mit Sotorasib + Panitumumab beim mCRC, ein Update der Validate-Studie und Daten zur PANIRINOX-Studie präsentiert.
Sotorasib plus Panitumumab beim mCRC
1) Sotorasib plus panitumumab versus standard-of-care for chemorefractory KRAS G12C-mutated metastatic colorectal cancer (mCRC): CodeBreak 300 phase 3 study – Mazard et al. (LBA30)
In die Codebreak 300 Phase 3 Studie wurden 160 Chemotherapie-refraktäre mCRC-Patient:innen mit einer KRAS G12C Mutation eingeschlossen und im Verhältnis 1:1:1 randomisiert auf die drei Studienarme Sotorasib (960mg) + Panitumumab (Soto960+Pani), Sotorasib (240mg) + Panitumumab (Soto240+Pani) und Standard of Care (SoC) verteilt. Zeitgleich zur Präsentation am ESMO 2023 wurde die Studie im NEJM publiziert (
Publikation hier anfordern).
Ergebnisse:
Wirksamkeit
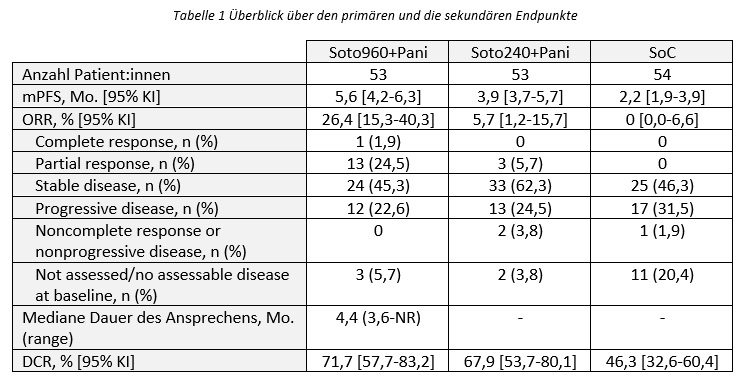
Der primäre Endpunkt (PFS) wurde in beiden Sotorasib + Panitumumab-Armen erreicht. Folgende mediane PFS Raten wurden berichtet:
- Soto960+Pani: 5,6 Mo. (HR=0,49 (95% KI: 0,30-0,80; p=0,006 vs. SoC))
- Soto240+Pani: 3,9 Mo. (HR=0,58 (95% KI: 0,36-0,93; p=0,03 vs. SoC))
- SoC: 2,2 Mo.
Im Soto960+Pani-Arm haben über 4x mehr Patient:innen auf die Therapie angesprochen als im Soto240+Pani-Arm (Tabelle 1).
Verträglichkeit
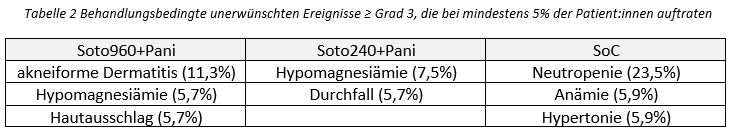
Die behandlungsbedingten unerwünschten Ereignisse ≥ Grad 3, die bei mindestens 5% der Patient:innen auftraten, unterschieden sich zwischen den Behandlungsgruppen. Es gab keine fatalen therapiebedingten Ereignisse.
Fazit:
Diese erste Phase III-Studie zur Kombination eines KRAS G12C-Inhibitors mit einem anti-EGFR-Antikörper erreichte den primären Endpunkt, beide Dosis-Kombinationen (Soto960+Pani & Soto240+Pani) zeigten einen signifikanten PFS-Vorteil
gegenüber dem Standard of Care. Die sekundären Endpunkte (z.B. Ansprechrate) wiesen ebenfalls einen bedeutenden Unterschied zugunsten der Kombination von Sotorasib mit Panitumumab auf.
Die Präsentation kann
hier heruntergeladen werden.
Panitumumab beim mCRC
1) Panitumumab (P) + FOLFIRINOX or mFOLFOX6 in unresectable metastatic colorectal cancer (mCRC) patients (pts) with RAS/BRAF wild-type (WT) tumor status from circulating DNA (cirDNA). First results of the randomised phase II
PANIRINOX-UCGI28 study – Mazard et al. (LBA30)
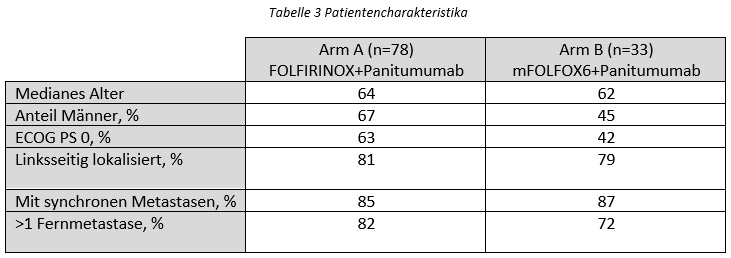
Die PANIRINOX-Studie untersucht die Rate des vollständigen Ansprechens (complete response, CR) von Patient:innen mit inoperablen RAS/BRAF V600E WT mCRC-Tumoren auf eine Therapie mit Panitumumab + FOLFIRINOX (Arm A) oder Panitumumab + mFOLFOX6 (Arm B). Der Mutationsstatus wird mittels cirDNA bestimmt. Die Stratifizierung der Patient:innen erfolgte anhand des Ausmaßes der Metastasierung (str1: Metastasierung auf die Leber limitiert, str2: Metastasierung nicht auf die Leber limitiert).
Zwischen Oktober 2017 und Juli 2022 wurden insgesamt 111 Patient:innen (str2) im Verhältnis 2:1 auf die beiden Arme (A:78, B:33) aufgeteilt (max. 12 Zyklen).
Ergebnisse:
Wirksamkeit
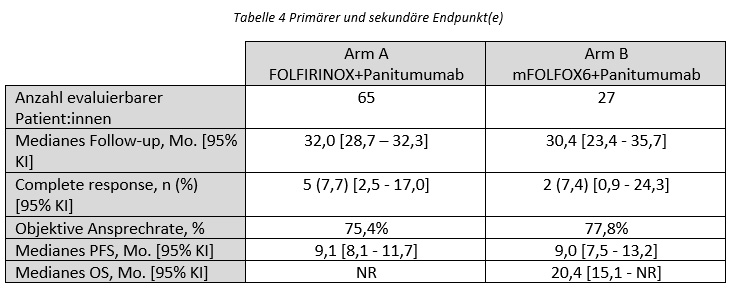
Nach einem medianen Follow-up von 32,0 respektive 30,4 Monaten lag das mediane PFS für Arm A bei 9,1 [8,1-11,7] Mo. und für Arm B bei 9,0 [7,5-13,2] Mo. (Tabelle 3). Das mediane OS wurde in Arm A nicht erreicht und lag bei Arm B bei 20,4 [15,1-NR] Mo.
Verträglichkeit
Die wichtigsten unerwünschten Ereignisse ≥ Grad 3 für Behandlungsarm A/B waren Durchfall (39%/9%), periphere Neuropathien (22%/24%) und dermale Ereignisse (18%/24%).
Fazit:
Die Studie erreichte den primären Endpunkt für Patient:innen, bei denen die Metastasierung nicht auf die Leber beschränkt war (str2). Die Ergebnisse waren in beiden Armen vergleichbar und unterstützen somit nicht den Einsatz einer intensivierten Chemotherapie in der ersten Behandlungslinie (entsprechend der TRIPLETE Studie;
Cremolini et al. 2022).
2) Evaluation of the metastatic colorectal cancer score (mCCS) in predicting outcome for patients with RAS wild type metastatic colorectal cancer (mCRC) treated with first-line (1L) panitumumab (PAN) plus FOLFIRI/FOLFOX: Updated interim results of the non-interventional study VALIDATE – Reiser et al. (662P)
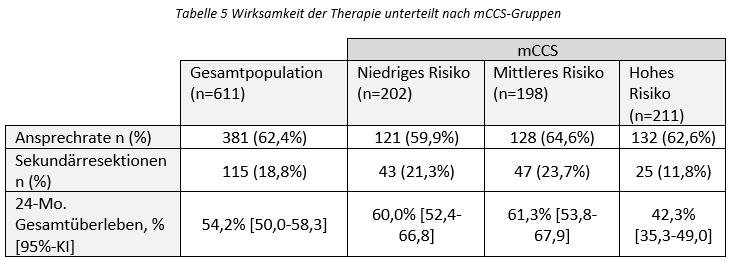
In der nicht-interventionellen Validate-Studie werden die „Real-World“-Wirksamkeit, -Verträglichkeit und Lebensqualität von Patient:innen mit RAS WT mCRC, die in Österreich und Deutschland in der Erstlinie mit Panitumumab plus FOLFOX/FOLFIRI therapiert werden, untersucht. Hierbei wird das Patientenkollektiv anhand des „metastatic colorectal cancer score“ (mCCS) in die drei Risikogruppen (niedrig, mittel und hoch) unterteilt.
Diese Interimsanalyse wurde 24 Monate nach dem Einschluss des letzten Patienten durchgeführt. Zum Zeitpunkt der Analyse gab es 611 auswertbare Patient:innen von 113 Zentren aus Deutschland (108) und Österreich (5). Das mittlere Alter lag bei 66,1 Jahren und der Anteil der männlichen Patienten betrug 68,9%. Bei 84,3% der 363 Patient:innen mit einem Kolonkarzinom war dieses linksseitig lokalisiert.
Ergebnisse:
Wirksamkeit
Die Patientengruppe, die laut mCCS ein mittleres Risiko aufweist, zeigte die höchste Ansprechrate (64,6%), die höchste Rate an Sekundärresektionen und das höchste 24-Monats-Gesamtüberleben (61,3%) (Tabelle 5).
Verträglichkeit
Die häufigsten behandlungsbedingten unerwünschten Arzneimittelwirkungen vom Grad 3/4 (TEADR) waren akneiforme Dermatitis (5,8%), Durchfall (3,2%) und Hautausschlag (2,9%). Der Tod eines Patienten durch eine arterielle Embolie wurde
vom behandelnden Studienarzt als behandlungsbedingt eingestuft. Insgesamt war das Verträglichkeitsprofil vergleichbar mit vorherigen Analysen.
Fazit:
Die Behandlung mit Panitumumab plus FOLFOX/FOLFIRI zeigt im Real-World-Setting eine ähnliche Wirksamkeit über alle mCCS-Risikogruppen.






